Unsere Leidenschaft: Therapie-Innovationen durch smarte Drug Device Combinations!
Medizintechnik, beispielsweise zur Inhalation oder Injektion, kann heute viel mehr als nur ein Medikament in den Körper einbringen. Neue Technologien ermöglichen präzisere Dosierungen, eine einfachere und sichere Handhabung oder auch die Messung der Therapietreue. Als Einheit mit dem Wirkstoff arbeiten wir so an der Verbesserung der Lebensqualität vieler Patienten.

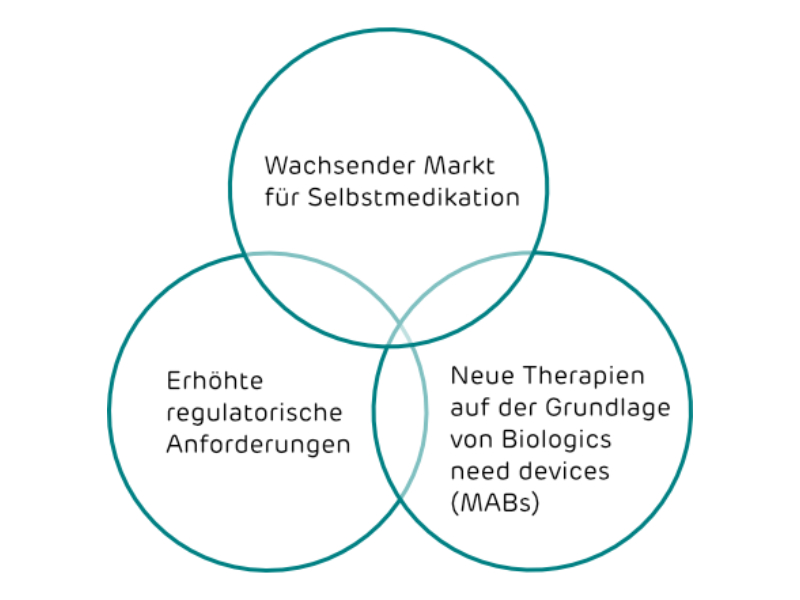
Wichtige Trends in der Medikamentenentwicklung
Innovative Therapien von morgen erfordern mehr Kombinationsprodukte
Mehr Kombonationsprodukte erfordern spezialisierte Technologieanbieter, die sowohl Medikament als auch Wikstoff verstehen. Activoris bietet ein Portfolio von Technologien für parenterale, pulmonale und ophthalmische Applikationen.
Erfahren Sie mehr über unsere Dienstleistungen beim Drug-Deivce Customizing.
WIR FREUEN UNS AUF IHRE HERAUSFORDERUNG!
Senden Sie uns gerne eine persönliche Nachricht oder rufen Sie uns an:
E-Mail: medtech@activoris.com TEL: +49 (0) 6453.585 35 00
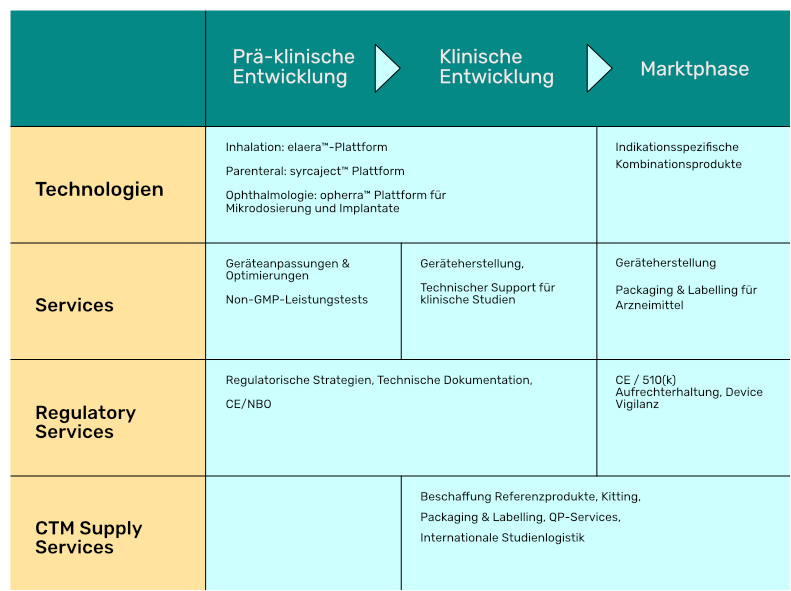
Unsere Technologien
Mesh Inhaler Plattform für pulmonale Applikationen
Mit elaera können wir auf eine jahrzehntelange Expertise in der Entwicklung hochwertiger Geräte für inhalative Arzneimittel aufbauen. Unser Entwicklungs-Know-how reicht bis ins Jahr 1998 zurück, als Aerosol-Wissenschaftler am Münchner Helmholtz-Zentrum den bahnbrechenden Vernebler für kontrollierte Atmung, AKITA®, erfanden.

Die neue elaera Mesh-Inhalatorplattform zielt auf anspruchsvolle Wirkstoffe ab, da wir sehen, dass biopharmazeutische Wirkstoffe aufgrund fragiler Moleküle und höherer Viskosität höhere Anforderungen an die Partikelerzeugung stellen.
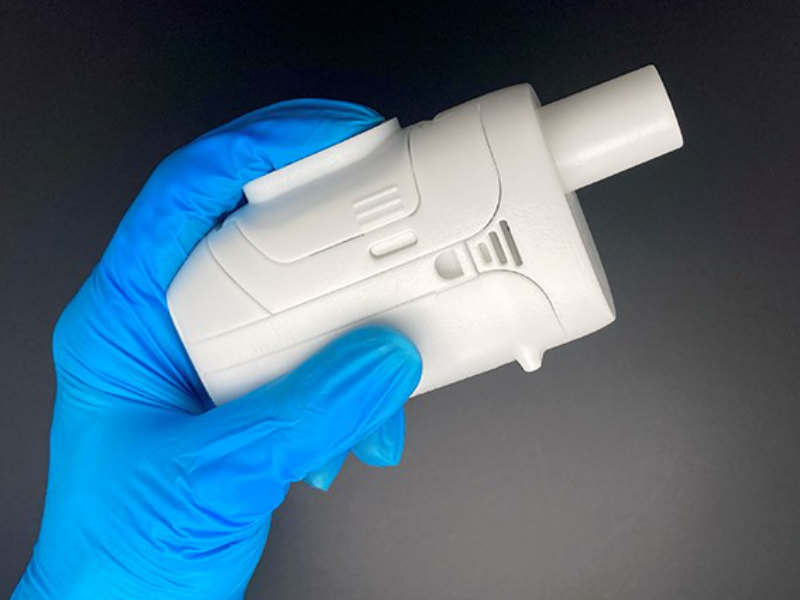
elaera™ - modernste Vernebelung anspruchsvoller Biopharmazeutika (Prototyp)
- Handgehaltener Meshvernebler, atemzuggetriggert, optimiert die Ihalationsgeschwindigkeit
- Starker Akku, großes Reservoir,
- Medikamenten-spezifische Dosierungseinheit (DCU)
- Einfaches Customizing an die jeweilige Medikamentenformulierung
- Schnittstelle zur automatischen Aufnahme rekonstituierter Medikamente
- Ready for Connectivity
Intra-Okulare Medikamentenverabreichung
Krankheiten des Auges
Die altersbedingte Makuladegeneration (AMD) betrifft jeden achten Menschen ab 60 Jahren und ist die häufigste Ursache für irreversible Erblindung bei älteren Menschen in den Industrieländern. Schätzungen zufolge leiden weltweit 200 Millionen Menschen an AMD, und bis 2040 wird diese Zahl voraussichtlich auf fast 300 Millionen ansteigen (Hrishikesh Vyawahare et al, 2022)
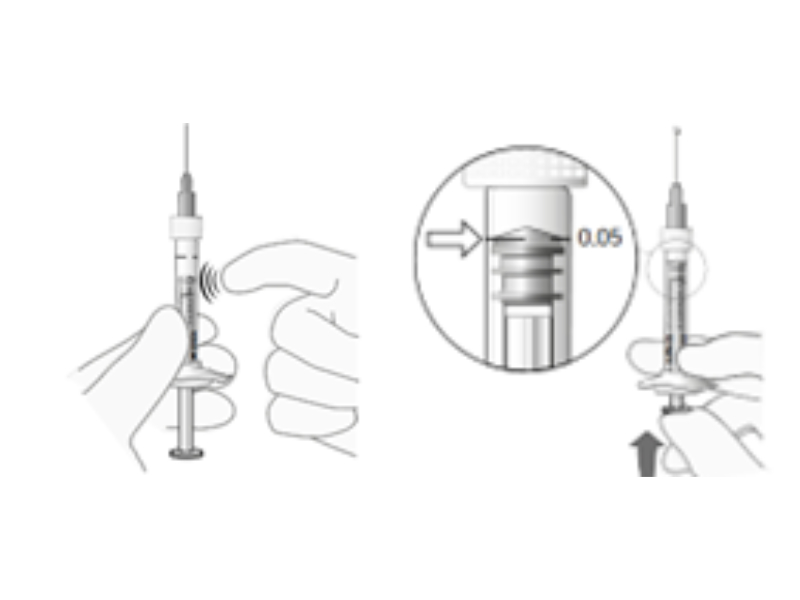
Herausforderung: Mikro-Dosierung
Die Vorbereitung und Verabreichung kleinster Dosen ophthalmischer Arzneimittel erfordert präzise Vorbereitung und manuelles Priming. Indikationserweierungen in pädiatrische Felder erfordern darüber hinaus eine weitere Verringerung der Dosierung (bsp. 20 µl). Hier sind Hilfsmittel erforderlich.
Die Zulassungsbehörden fordern vom pharmazeutischen Entwickler Maßnahmen, die Sicherheit durch die Verringerung von Anwendungsfehlern zu verbessern.
Mit opherra™ betreten wir den Bereich der ophthalmischen Verabreichung. Es gibt eine Vielzahl von innovativen Wirkstoffen, die helfen sollen, das Augenlicht zu erhalten. Gleichzeitig besteht ein enormer medizinischer Bedarf, die Sicherheit und Anwendbarkeit bei der Anwendung am Auge zu verbessern.

Unsere opherra Plattform bietet eine Reihe von Verbesserungen gegenüber den derzeitigen Verabreichungsgeräten, die dazu beitragen, Anwendungsfehler zu reduzieren und somit dem Patienten mehr Sicherheit zu bieten. Unsere Technologien können mit verschiedenen Medikamenten kombiniert werden und bilden so eine Plattform zur Verbesserung vieler Anwendungen.
Verbesserte Eigenschaften für die Abgabe von kleinen µl-Dosen:
- Kombinierbar mit vorgefüllten Spritzen
- Einfach apssbarer Übersetzungsmechanismus
- Definiertes Priming, definierte Dosierung durch definierten Kolbenhub
- Anpassbar an verschiedene Spritzengrößen
- Übersetzung erlaubt Dosierung hochviskoser Wirkstoffe
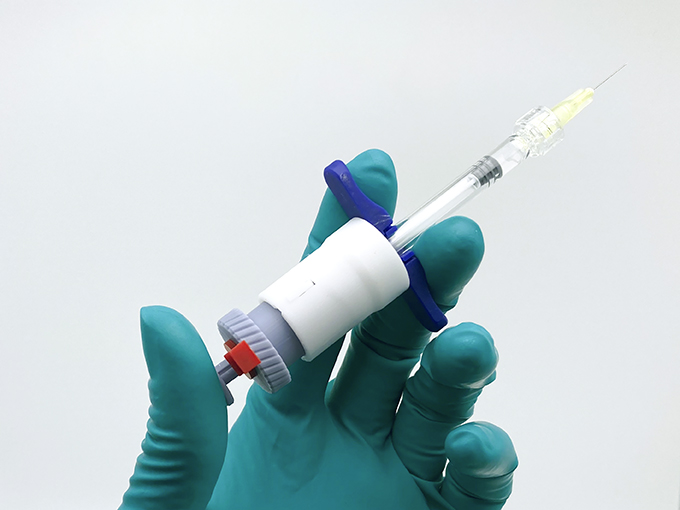
opherra™ liquid microdosing: Verabreichung von Kleinstdosen in der Augenheilkunde (Prototyp)
opherra™ solid: Sichere Applikation von Implantaten
Wirkstoffimplantate stellen eine einzigartige Lösung für die Behandlung von Erkrankungen des Auges dar. Allerdings handelt es sich hierbei um den invasivsten Verabreichungsweg, der nicht frei von injektionsbedingten Komplikationen ist.
Unsere opherra solid-Technologie zielt darauf ab, mehrere Herausforderungen und Risikofaktoren der derzeit auf dem Markt befindlichen Verabreichungsgeräte für Implantate zu adressieren:
Verbesserte Funktionen für mehr Komfort und Patientensicherheit:
- Stiftform: präzise Platzierung
- Triggermechanismus parallel zur Injektionsrichtung, um zusätzlichen Druck auf das Auge zu vermeiden.
- Langsame Freisetzung des Implantats durch Übersetzungsmechanismus
- Priming: Medikamentenpellet wird vor der Injektion an die Nadelspitze geschoben: Vermeidung von Luftblasen
- Ergonomsches Design für guten Halt während der Injektion und Auslösung.
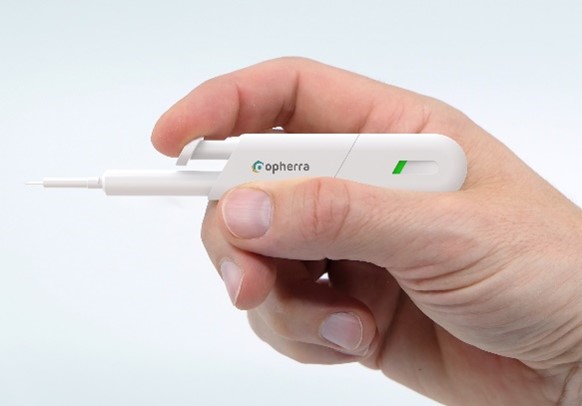
opherra™ solid: fortschrittliche Verabreichung von Implantaten (Prototyp)
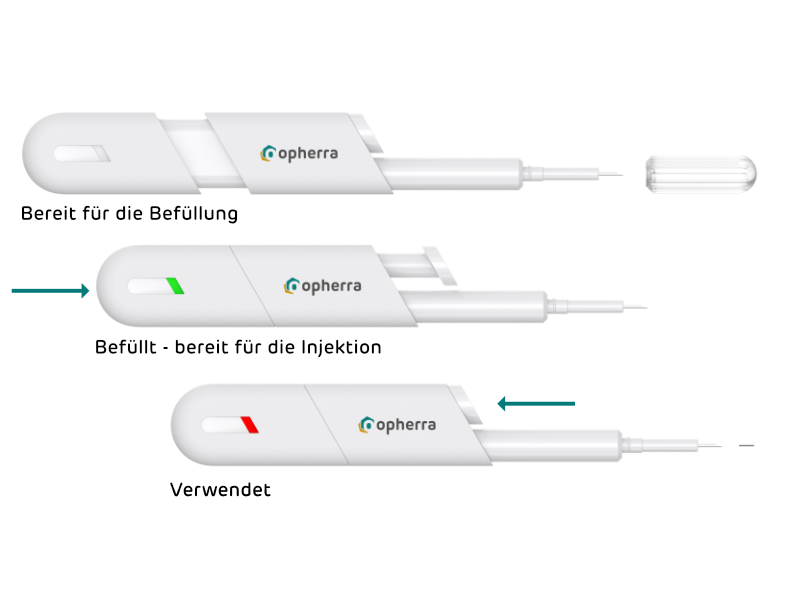
Einfache und logische Schritte für mehr Sicherheit der intraoularen Injektion (Prototyp).

Fenster zeigt Gerätestatus in der Sichtlinie an (Prototyp).
Transformation einer Kartusche in eine Fertigspritze: syrcaject™

Viele Biopharmazeutika werden als Injektionssystem, Pens oder Fertigspritzen zur Selbstverabreichung entwickelt. Hier kommen im Zielsystem häufig Kartuschen zum Einsatz. Pharmazeutsche Kartuschen bieten viele Vorteile, sie können jedoch nicht direkt als Applikationssystem eingestzt werden.
syrcaject nimmt Standard-Kartuschen auf und kann so wie eine Fertiggspritze verwendet werden. Somit wird die Kartusche zur Plattform für verschiedenste Anwendungen. syrcaject kombiniert die Vorteile der Kartusche mit einer Fertigspritze und kann weitere Zusatzfunktionen erfüllen.
syrcaject:
- Nutzt alle Vorteile einer Kartusche und vermeidet die Nachteile einer vorgefüllten Spritze
- Einsetzbar mit verschiedenen Nadeltypen (Luer, Staked-in, Slip)
- Unterschiedliche Kolben zur Dosierung
- Entwickler von Medikamenten/Geräten können sich auf ein bekanntes Primärbehältnis mit bekannten Eigenschaften verlassen.
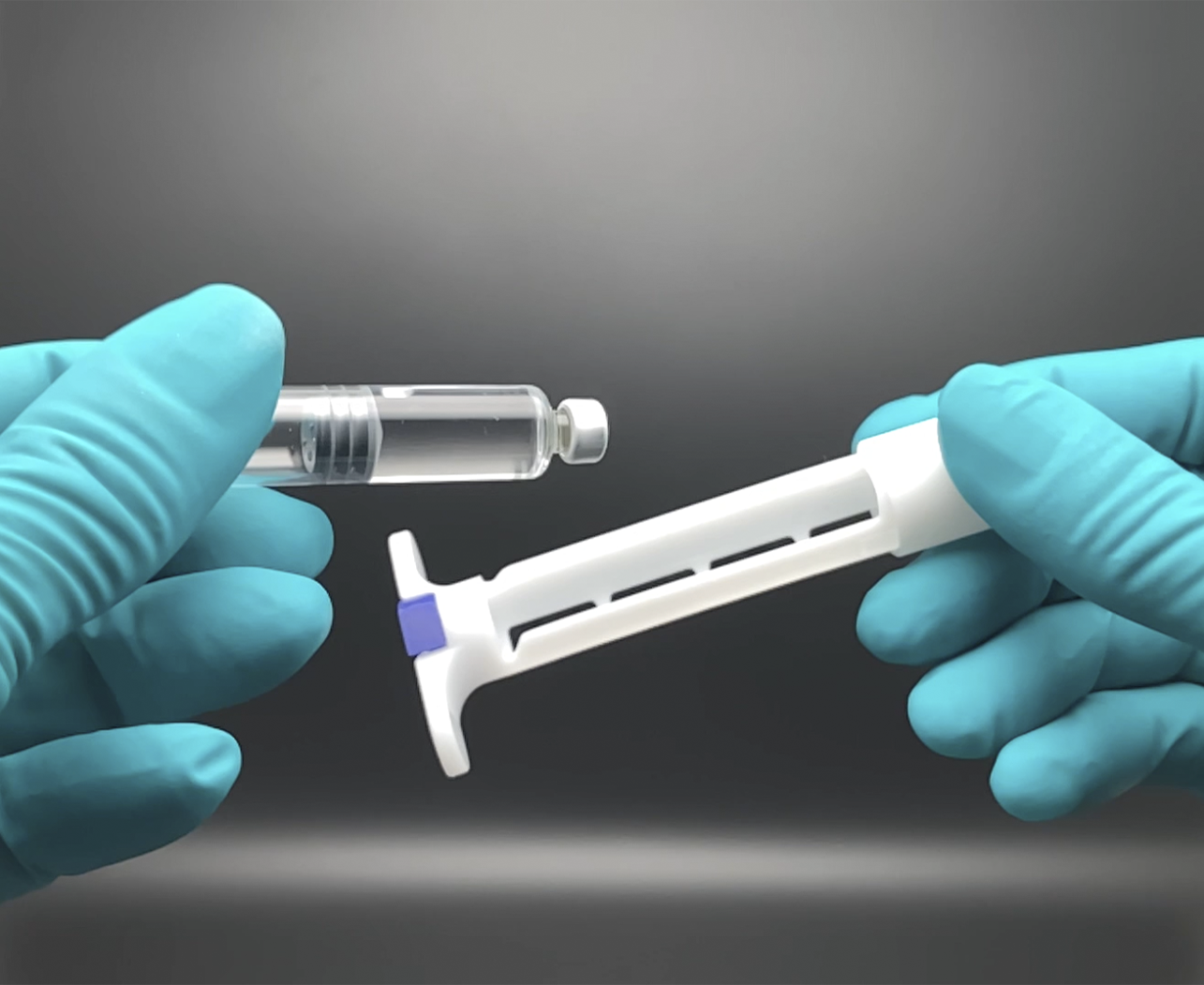
syrcaject™: Verwandelt eine Kartusche in eine vorgefüllte Spritze (Prototyp)
Pharmazeutische Kartuschen sind als Primärpackmittel für verschiedenste Anwendungen seit langem bekannt. In der Entwicklung wird jedoch häufig mit einem Vial begonnen. Stabilitätsuntersuchungen müssen somit mehrfach durchgeführt werden, wenn das kommerzielle Applikationssystem sich später ändert.
Ein wirksames Instrument für frühe klinische Studien – und mehr!
Durch den sofortigen Einsatz einer Kartusche kann die Medikamentenentwicklung beschleunigt werden, das Bridging von Primärbehältern ist nicht mehr notwendig. Darüber hinaus ermöglichen flexible und speziell gerillte Kolbenstangen feste und reproduzierbare Dosierungen. Also: verbesserte Sicherheit und Effizienz bei gleichzeitig reduziertem Risiko.
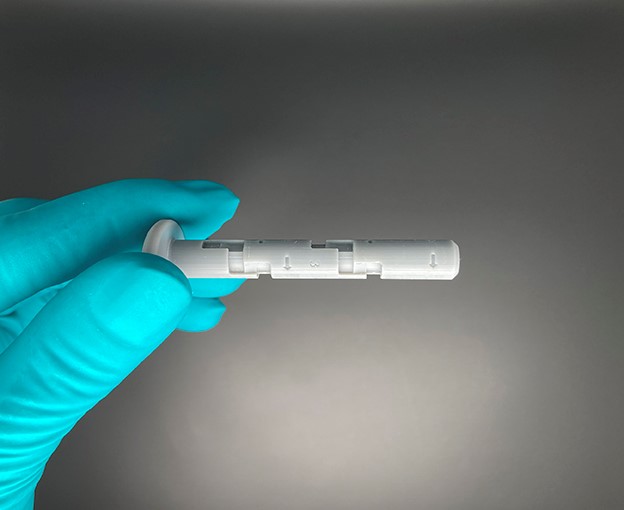

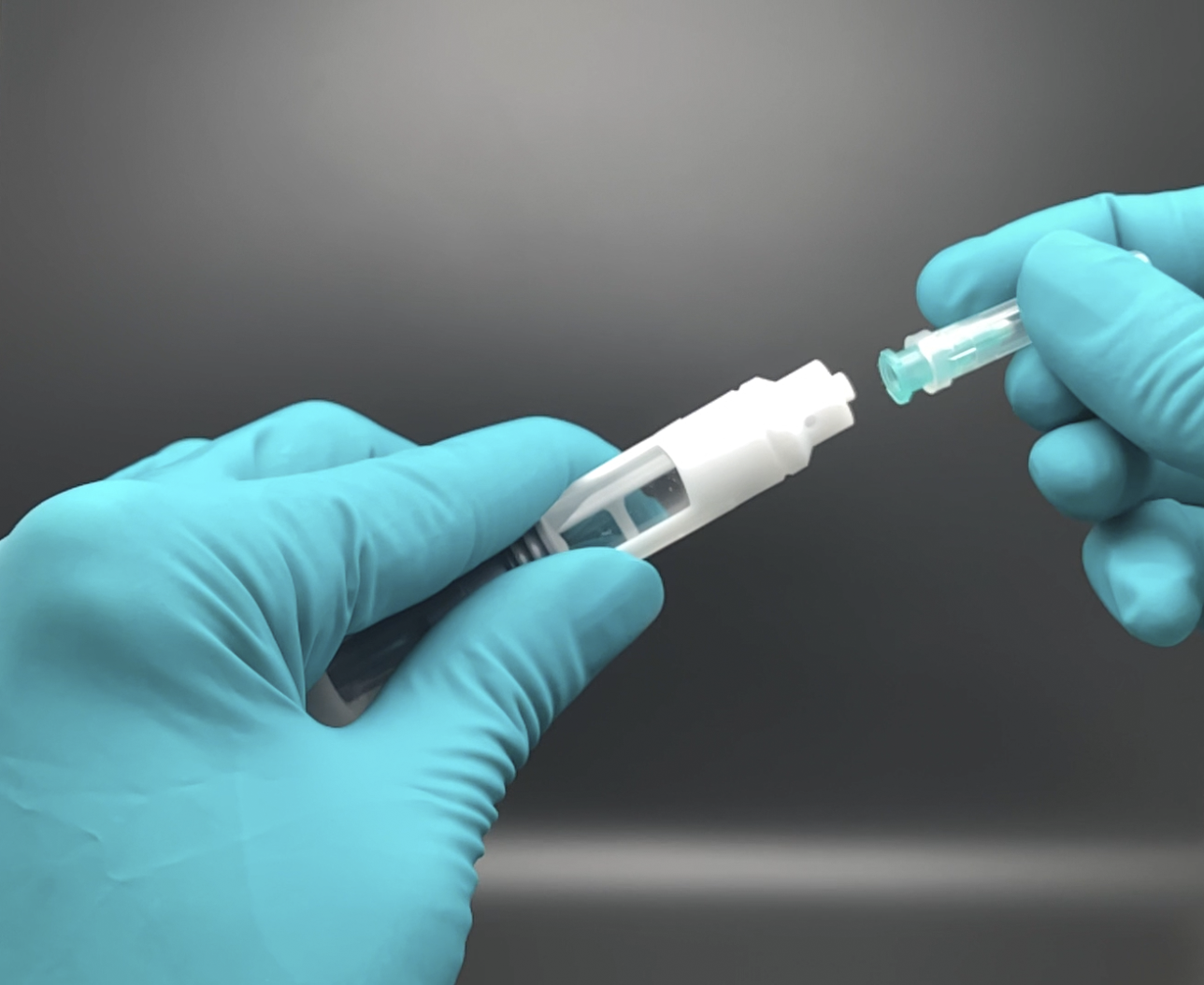
Die syrcaject-Plattform umfasst das Gehäuse für ISO-Kartuschen mit unterschiedlichen Volumina, mit oder ohne Kanüle, oder einen Luer-Anschluss.
Mit der syrcaject-Technologie können Biotech-Unternehmen eine schnellere Entwicklung, bessere Daten und geringere Entwicklungskosten erzielen. Dies kann ein wichtiges Argument für die Durchführung einer klinischen Studie mit dieser Technologie sein.
Frühzeitige Verwendung von syrcaject beschleunigt Pharma-Entwicklungen
Mit der syrcaject-Technologie können Biotech-Unternehmen eine schnellere Entwicklung, bessere Daten und geringere Entwicklungskosten erzielen. Dies kann ein wichtiges Argument für die Durchführung einer klinischen Studie mit dieser Technologie sein.
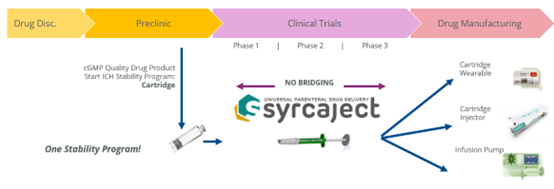
Systeme zur Rekonstitution und Transfer

Viele Injektions- und Inhalationspräparate müssen vor dem Gebrauch rekonstituiert werden. Damit sind bis zu zwölf Arbeitsschritte für den Anwender verbunden. Arbeitsschritte, die Zeit kosten und bei denen auch Fehler gemacht werden können, die zu Lasten der Patientensicherheit gehen. Unser rapimixin-System ist eine einfache Plattform, die ein gebrauchsfertiges System zum Mischen eines Lösungsmittels in ein Arzneimittelfläschchen bietet. Die Plattform besteht aus Varianten für verschiedene Primärbehälter, die ein Lösungsmittel enthalten:
- Pharmazeutische Kartuschen
- Spritzen (Luer-Lock)
- BFS-Ampullen
Die Komponenten können verkaufsfertig kombiniert werden, und die bestehende Zulassung des Arzneimittels wird nur minimal angetastet, da kein Wechsel der Primärverpackung erforderlich ist. Das System ist für terminale Sterilisation ausgelegt. Rapimixin hat dann die Möglichkeit, verschiedene Schnittstellen zu nutzen:
- Kanüle
- Andere Medikamentenbehälter

rapimixin:
- Einhandbedienung möglich
- Kombiniert Auflösung und Transfer in einem Gerät
- Kein Wechsel des primären Medikamentenbehälters
- Kann vorverpackt und terminal sterilisiert werden.
- Nimmt bis zu 5 ml pharmazeutische ISO-Kartuschen auf.
- Die Konzentration kann im Voraus bestimmt werden: reduzierte Fehlerquelle.
rapimixin™: einfache und sichere Rekonstitution und Übertragung von Arzneimitteln
Unsere Dienstleistungen für Ihr Customizing-Projekt
Wir sind der richtige Partner für Ihre Projekte entlang der Wertschöpfungskette. Von Anfang bis Ende.
Sie suchen integriertes Know-how für Kombinationsprodukte mit Anforderungen aus medizintechnischen und pharmazeutischen Regularien. Unsere Technologieplattformen, kombiniert mit unseren Entwicklungs- und Produktionskapazitäten, bieten Ihnen Dienstleistungen in allen Phasen der Entwicklung aus einer Hand.

Activoris Medizintechnik GmbH
Sitz und Verwaltung, Produktion
Wohraer Str. 37
35285 Gemünden (Wohra)
Germany
+49.6453.58535.0
+49.6453.58535.25
Entwicklung
Robert-Koch-Allee 29
82131 Gauting
Germany
+49.6453.58535.61
+49.6453.58535.25
syrcaject- und opherra-Plattformtechnologien entwickelt in Zusammenarbeit zwischen Activoris und Stephen T. Dunne.
Activoris Food Packaging GmbH
Sitz und Verwaltung
Wohraer Str. 37
35285 Gemünden (Wohra)
Germany
+49.6453.58535.0
+49.6453.585350.25
Produktion
An der Lämmerweide 10
34613 Schwalmstadt
+49.6691.91230.0
+49.6691.91230.25